Capítulo 4. Metabolismo y energía
Clases de energía y transformaciones energéticas
1. La energía se manifiesta de diferentes formas (eléctrica, radiante, química, nuclear) que pueden ser interconvertidas casi sin restricciones. La termodinámica estudia la conversión de una forma de energía en otra.
2. En los seres vivos, las conversiones energéticas están gobernadas por las leyes de la termodinámica.
Principio de conservación de la energía: primera ley de la termodinámica
3. La primera ley de la termodinámica dice que "La energía del Universo permanece constante". Esto significa que la energía no se crea ni se destruye, pero puede ser transformada.
4. Los seres vivos son sistemas abiertos que intercambian materia y energía con el ambiente. Cuando en un ser vivo ocurre un proceso determinado, la energía que se pierde o se disipa es igual a la que gana el ambiente.
5. La vida es un proceso de combustión. Los organismos oxidan carbohidratos y convierten la energía almacenada en los enlaces químicos en otras formas de energía, según la siguiente reacción global, que expresa la oxidación de la glucosa: C6H12O6 + 6O2 → 6CO2 + 6H2O + Energía.
6. La energía total liberada durante la oxidación de la glucosa está compuesta por una fracción "útil" y una fracción que se disipa en forma de calor.
Dirección de los procesos naturales: segunda ley de la termodinámica
7. Los procesos naturales espontáneos tienden a disipar los gradientes hasta alcanzar un estado de equilibrio. En este sentido, los desequilibrios y heterogeneidades pueden considerarse almacenes de energía "útil" que permiten que los procesos ocurran. La cantidad de energía "útil" será igual a la energía total puesta en juego durante el proceso, menos cierta cantidad de energía que, inevitablemente, se disipará.
8. La energía disipada puede expresarse como el producto entre la temperatura y un factor llamado entropía (H). La segunda ley de la termodinámica dice que "La entropía del Universo tiende a un máximo". Esto significa que los procesos naturales espontáneos ocurren siempre en una misma dirección: la que conduce a un aumento de la entropía.
9. En un sistema aislado, la energía "útil" es usada para convertir las heterogeneidades en homogeneidades. Cuando esta energía se agota, el sistema alcanza el equilibrio, la entropía es máxima y ya no puede ocurrir ningún otro proceso. En estos sistemas, la entropía permite predecir la dirección de los procesos espontáneos.
¿Qué es la vida?: los sistemas biológicos y la segunda ley de la termodinámica
10. Los seres vivos son estructuras complejas, extremadamente ordenadas, claramente diferenciadas de su entorno, dotadas de información y alejadas por completo del estado de equilibrio. Para mantener su organización, requieren un suministro constante de energía.
11. En los seres vivos conviven dos procesos esenciales: la generación de orden a partir de orden (producen réplicas de sí mismos) y la generación de orden a partir de desorden (se mantienen alejados del equilibrio).
12. Los sistemas biológicos deben considerarse juntamente con su entorno. Los organismos ganan orden interno a expensas de generar desorden en su ambiente. De esta manera, la entropía del conjunto siempre aumenta. El sistema se mantiene estacionario porque existen procesos balanceados.
Reacciones químicas en los seres vivos
13. Las reacciones químicas de oxidorreducción son aquellas que implican el movimiento de electrones de un átomo (o molécula) a otro. El átomo (o la molécula) que cede un electrón se oxida; el que lo recibe, se reduce.
14. La entalpía (S) es la cantidad de energía puesta en juego durante una reacción química en condiciones de presión constante. Esta energía es igual al calor cedido o ganado al ocurrir la reacción. La entalpía global de una reacción es siempre igual a la diferencia de entalpía entre los productos y los sustratos. Si al producirse la reacción se libera energía, la entalpía de los productos disminuye. Este tipo de reacción se denomina exotérmica. Si absorbe energía, se denomina endotérmica.
15. La función termodinámica más utilizada en bioquímica es la energía libre de Gibbs (G), cuya variación en una reacción química se expresa como ∆G = ∆H - T∆S. La dirección natural de toda reacción es aquella en la que disminuye su energía libre; por lo tanto, cuando el valor de su ∆G es negativo, se puede predecir que la reacción ocurrirá en forma espontánea. Este hecho explica por qué aun las reacciones endotérmicas pueden ser espontáneas.
Los participantes celulares en la transformación energética
16. Las enzimas son proteínas globulares formadas por una o más cadenas polipeptídicas. Aceleran la velocidad de las reacciones químicas, participando en su mecanismo pero sin sufrir un cambio químico permanente. También influyen sobre el rendimiento, ya que aseguran que todo el reactivo se transforme en producto y que no aparezcan productos secundarios.
17. Todas las enzimas presentan un sitio activo en el que se acomodan los sustratos. Las enzimas que catalizan los procesos metabólicos básicos son altamente específicas. Esta especificidad se basa en el reconocimiento de formas entre las superficies del sitio activo y del sustrato.
Fig. 4-11. Hipótesis del ajuste inducido
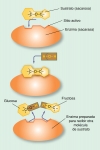
Previo a la interacción con el sustrato, el sitio activo de la enzima se encuentra en una forma relajada pero capaz de reconocer específicamente a su sustrato. Al producirse la interacción, el sustrato induce un íntimo ajuste con el sitio activo. Esta reacomodación del sitio activo provoca una tensión en la molécula del sustrato que facilita la reacción. Finalmente, los productos se liberan.
18. La energía de activación es la diferencia entre la energía libre de los reactivos y sus estados intermedios. Para que una reacción química ocurra, los reactivos deben alcanzar la energía de activación. Así, la velocidad de una reacción química es proporcional a la cantidad de átomos o moléculas que estén alcanzando la energía de activación en un tiempo dado. Por esta razón, las velocidades de reacción dependen de la temperatura y de la concentración de los reactivos.
19. Las enzimas forman asociaciones temporales con las moléculas reactivas y así disminuye la energía de activación. Estas asociaciones acercan y debilitan los enlaces químicos existentes, lo cual facilita la formación de otros nuevos.
20. Muchas enzimas sólo funcionan en presencia de cofactores o coenzimas. Los cofactores son iones o moléculas orgánicas no proteicas y de bajo peso molecular. Las coenzimas suelen recibir y transferir electrones.
Metabolismo: red de redes
21. El metabolismo es la suma de las reacciones químicas que ocurren en los seres vivos. Las células son el "recipiente" donde se llevan a cabo estas reacciones y las enzimas son sus piezas más importantes.
22. El anabolismo abarca las reacciones de biosíntesis de las partes estructurales y funcionales de las células; el catabolismo, las de degradación, que proveen la energía y los materiales necesarios para la biosíntesis.
23. Las vías metabólicas son los pasos ordenados en que se agrupan las reacciones metabólicas. Algunas vías metabólicas, como la glucólisis y la respiración, ocurren en casi todos los seres vivos.
24. La ciencia concibe el metabolismo como una red de redes. En los nodos están las enzimas y las proteínas relacionadas, las conexiones son establecidas por los metabolitos o productos intermediarios.
Regulación de la actividad enzimática
25. Las enzimas alostéricas pueden activarse o desactivarse temporalmente. Esto ocurre cuando una segunda molécula (efector alostérico) se une a un sitio de la enzima distinto del sitio activo. Al producirse la unión, la conformación de la enzima cambia y su sitio activo se modifica.
Fig. 4-14. Efectores alostéricos
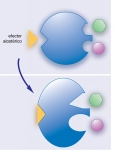
Un efector alostérico es una molécula pequeña que puede interactuar con enzimas en regiones diferentes del sitio activo. Esta unión tiene un impacto drástico sobre la estructura terciaria o cuaternaria de las enzimas, que en consecuencia altera su actividad. Los efectores alostéricos pueden actuar como activadores o, como se muestra en la figura, inhibidores.
26. En otros casos, la regulación consiste en sintetizar las enzimas sólo cuando son necesarias.
27. La regulación postraduccional abarca cualquier modificación producida en la estructura de las enzimas una vez que han sido sintetizadas. Algunas enzimas son polipéptidos inactivos que se activan cuando otra enzima los corta. Otra forma de activar o inactivar una enzima es mediante la unión covalente de grupos fosfato a los residuos de aminoácidos.
28. La temperatura regula en forma más general la actividad enzimática. En la mayoría de los casos, la velocidad de una reacción se duplica por cada 10 °C que aumenta la temperatura y decae rápidamente por encima de los 40 °C.
29. Los inhibidores enzimáticos pueden unirse al sitio activo de una enzima (inhibición competitiva) o a un sitio diferente del activo (inhibición no competitiva). Si el inhibidor desnaturaliza a la enzima o se une en forma permanente al sitio activo, la inhibición es irreversible.
ATP: la moneda energética de la célula
30. El trifosfato de adenosina (ATP) está formado por la base nitrogenada adenina, el azúcar de cinco carbonos ribosa y tres grupos fosfato. Los enlaces covalentes entre los tres grupos fosfato son de alta energía. La energía que se libera cuando estos enlaces son hidrolizados es suficiente para poner en marcha muchas reacciones celulares.
Fig. 4-19. ATP y ADP
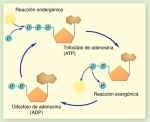
Se presume que la interconversión entre ATP y ADP es una de las reacciones mayoritarias en los organismos vivos. Se ha estimado que un ser humano utiliza 40 kg de ATP por día. Esto implicaría que cada molécula de ADP es fosforilada a ATP y posteriormente desfosforilada unas 1.000 veces por día.
33. La fosforilación es la transferencia del grupo fosfato terminal del ATP a otra molécula. La desfosforilación es la eliminación de los grupos fosfato. Ambas reacciones son catalizadas por enzimas y cumplen un papel importante en la regulación de muchas actividades de la célula.
